Ngày nay, xu hướng điều trị bệnh hướng đích đang được quan tâm nghiên cứu mạnh mẽ. Đây là chiến lược sử dụng những vật trung gian như liposome, virus hoặc vi khuẩn để vận chuyển các tác nhân trị liệu đến đúng mục tiêu điều trị. Đặc biệt, việc sử dụng vi khuẩn ngày càng được nghiên cứu sâu hơn do có những ưu điểm vượt trội về tính an toàn và hệ thống biểu hiện protein. So với liposome hay virus, vi khuẩn có thể vừa là nhà máy sản xuất thuốc vừa là phương tiện vận chuyển thuốc.
Nhiều nghiên cứu trên thế giới đã sử dụng những loài vi khuẩn có khả năng xâm nhập chuyên biệt vào các tế bào chủ như Listeria monocytogenes, Salmonela sp. hay Shigella sp. để vận chuyển DNA hoặc protein trị liệu đến đúng vị trí điều trị [3], [4], [6]. Tuy nhiên, chúng có khả năng gây bệnh cho người và động vật nên không an toàn khi ứng dụng rộng rãi. Do đó, các loài vi khuẩn khác có khả năng vận chuyển thuốc hướng đích nhưng an toàn hơn cần được quan tâm nghiên cứu. Với sự phát triển mạnh mẽ của kĩ thuật di truyền, nhiều loài vi khuẩn tái tổ hợp đã được tạo ra cho mục đích trên như Escherichia coli hay Lactococcus [1], [2]. Tuy nhiên, những công bố khoa học dựa trên mô hình này hiện nay vẫn còn tồn tại một số hạn chế, trong đó chủ yếu là hạn chế về việc biểu hiện và kiểm soát sự biểu hiện một cách chủ động của các protein trị liệu. Thuật ngữ Microbiorobot ra đời nhằm chỉ những vi khuẩn - sinh vật tái tổ hợp an toàn, có khả năng xâm nhập vào cơ thể động vật ở những vị trí chuyên biệt và có khả năng cung cấp các tác nhân trị liệu một cách chủ động theo ý muốn của con người thông qua việc kiểm soát các tác nhân cảm ứng. Microbiorobot là một hướng nghiên cứu mới mang nhiều tiềm năng ứng dụng to lớn trong lĩnh vực y học hiện đại.
Mô hình của định hướng phát triển Microbiorobot đang được tiến hành nghiên cứu tại Trường Đại học Khoa học Tự nhiên – Đại học Quốc gia Tp Hồ Chí Minh là vi khuẩn Bacillus subtilis. Chúng được trang bị các gene mã hóa cho một số protein tái tổ hợp được kiểm soát biểu hiện một cách chủ động khi ở bên ngoài hay bên trong tế bào/ cơ thể động vật chủ. Đầu tiên, các chủng vi khuẩn này sẽ được trang bị protein có khả năng bám dính đặc hiệu với tế bào chủ nhằm xâm nhập vào tế bào/ mô mục tiêu, và một protein khác cho phép chúng thoát khỏi các bong thực bào (vacuole) để có thể tồn tại an toàn bên trong tế bào động vật. Sau đó, Microbiorobot được trang bị thêm một protein chức năng như:
(i) Tiêu diệt tế bào chủ để tấn công đặc hiệu các tế bào khối u (cancer).
(ii) Thực hiện các chức năng bổ khuyết những thiếu hụt trong cơ thể.
(iii) Có vai trò kháng nguyên dung như một tác nhân phân phối vaccine.
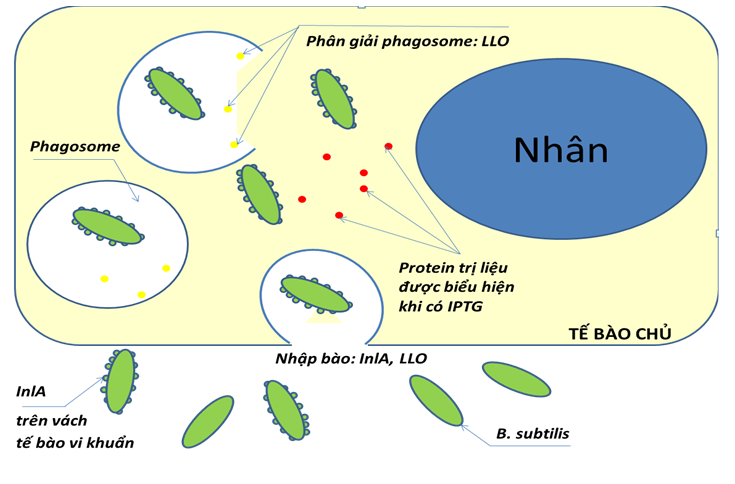
Hình 1: Ví dụ về một mô hình Microbiorobot.
Mô hình này được mô phỏng theo cơ chế xâm nhiễm tế bào chủ của Listeria monocytogenes. Protein Internalin A (InlA) có chức năng gắn lên bề mặt tế bào chủ. Protein Lysteriolysin O (LLO) có chức năng giúp tế bào thoát khỏi không bào để có thể sống trong tế bào động vật. IPTG, đại diện cho các phân tử nhỏ được sử dụng để điều khiển sự biểu hiện protein tái tổ hợp trong tế bào vi khuẩn/ Microbiorobot.
Hiện tại nhóm nghiên cứu đã và đang hoàn tất việc phát triển các công cụ sử dụng trong việc tạo ra các microbiorobot. Các vector biểu hiện nội bào và tiết đã được thiết lập (xem hướng phát triển vector biểu hiện), hệ thống gắn protein lên bề mặt tế bào đã và đang được nghiên cứu.
Với thế mạnh trong lính vực nghiên cứu hệ thống biểu hiện protein tái tổ hợp trong B. Subtilis cùng với sự trợ giúp về Bioinformatics, nhóm nghiên cứu tại Trường Đại học Khoa học Tự nhiên hy vọng phát triển mô hình này thành các Microbiorobot khác nhau có khả năng kiểm soát được trong tế bào/ cơ thể động vật chủ, cung cấp nhiều protein trị liệu khác nhau vào cơ thể động vật một cách chủ động, mở ra những hướng nghiên cứu liệu pháp điều trị bệnh hướng đích mới có tiềm năng lớn trong tương lai.
Tài liệu tham khảo
[1] Buttaro, C. and Fruehauf, J.H. (2010), “Engineered E. coli as vehicles for targeted therapeutics”, Current gene therapy, 10(1), 27–33.
[2] Guimarães, V.D., Gabriel, J.E., Lefèvre, F., Cabanes, D., Gruss, A., Cossart, P., Azevedo, V. and Langella, P. (2005), “Internalin-expressing Lactococcuslactis is able to invade small intestine of guinea pigs and deliver DNA into mammalian epithelial cells”, Microbes and infection / Institut Pasteur, 7(5-6), 836–844.
[3] Jia, L.-J., Wei, D.-P., Sun, Q.-M., Huang, Y., Wu, Q. and Hua, Z.-C. (2007), “Oral delivery of tumor-targeting Salmonella for cancer therapy in murine tumor models”, Cancer science, 98(7), 1107–1112.
[4] Sizemore, D.R., Branstrom, A.A. and Sadoff, J.C. (1995), “Attenuated Shigella as a DNA delivery vehicle for DNA-mediated immunization”, Science (New York, N.Y.), 270(5234), 299–302.
[5] Tangney, M. and Gahan, C.G.M. (2010), “Listeria monocytogenes as a vector for anti-cancer therapies”, Current gene therapy, 10(1), 46–55.
[6] Nguyen HD, Schumann W. 2006. Establishment of an experimental system allowing immobilization of proteins on the surface of Bacillus subtilis cells. J Biotechnol 122: 473-482.
[7] Nguyen HD, Phan TT, Schumann W. 2011. Analysis and application of Bacillus subtilis sortases to anchor recombinant proteins on the cell wall. AMB Express 1: 22.

